नोबेल जीतने वाले उन तीन लोगों से मिलिए, जिनकी बदौलत आप पड़ोसी से पतली पिन का चार्जर मांग पाए
मोबाइल ने हमारा जीवन बदला और इन्होंने मोबाइल का.
Advertisement

लेफ्ट से राइट - जॉन गुडइनफ़, स्टेनली व्हिटिंगम, अकीरा योशिनो. (सोर्स - नोबेल)
बात 'लिथियम आयन बैटरी' की हो रही है. वही बैटरी, जिसने बिजली को तार के जंजाल से आज़ाद कर दिया. नोबेल कमिटी के शब्दों में कहूं तो वो बैटरी जिसने एक 'रीचार्जेबल दुनिया' का निर्माण किया. लिथियम आयन बैटरी की कहानी तीन लोगों के कंधे पर बैठकर अपने अंजाम तक पहुंची.
1. स्टेनली व्हिटिंगम 2. जॉन गुडइनफ़ 3. अकीरा योशिनोइन तीनों को 10 दिसंबर को 2019 का केमिस्ट्री नोबेल प्राइज़ दिया जाएगा. और तीनों में इनाम की राशि बराबर बंटेगी.
अल्फ्रेड नोबेल की मौत 10 दिसंबर, 1896 को हुई थी. इसी दिन बांटते हैं नोबेल प्राइज़. (सोर्स – नोबेल प्राइज़)
जब तक ये लोग पइसा बांटते हैं, हम लोग लिथियम आयन बैटरी के बारे में ज्ञान बांट लेते हैं.
बैटरी की ज़िंदगी का एक्कई मकसद - करेंट
जब हमारे शरीर के अंदर खून बहता है, तो हमारा शरीर काम करता है. इसी तरह हमारे बनाए उपकरण तभी काम करते हैं जब उनमें करेंट बहता है. हमें बैटरी से यही एक चीज़ चाहिए - करेंट. लेकिन करेंट होता क्या है? करेंट मतलब किसी तार में इलेक्ट्रॉन्स का बहना.और इलेक्ट्रॉन्स क्या होते हैं? ये जानने के लिए हमें थोड़ी गहराई में झांकना होगा.
जैसे कोई भी भाषा वर्णों से मिलकर बनती है. ये दुनिया कुछ एटम्स से मिलकर बनी है. अलग-अलग टाइप के एटम. और सबसे बेसिक मॉडल के हिसाब से कोई भी एटम तीन चीज़ों से मिलकर बनता है.
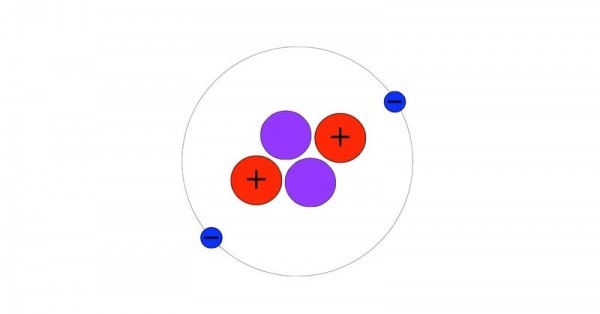
प्रोटॉन - पॉज़िटिव चार्ज की सबसे छोटी इकाई इलेक्ट्रॉन - नेगेटिव चार्ज की सबसे छोटी इकाई न्यूट्रॉन - कोई चार्ज नहीं. न्यूट्रल रहता हैएटम का बेसिक मॉडल हमारे सौरमंडल की तरह है. प्रोटॉन और न्यूट्रॉन की एक गेंद बीचोंबीच होती है. इसे न्यूक्लीयस कहते हैं और इलेक्ट्रॉन्स इस न्यूक्लीयस के चक्कर काटते हैं. आइडियली एक एटम में इलेक्ट्रॉन और प्रोटोन की संख्या बराबर होती है.
ये हीलियम का एटम है. माइनस(-) साइन वाले गोले इलेक्ट्रॉन्स हैं. प्लस(+) वाले गोले प्रोटॉन्स हैं. जिनपर कोई निशान नहीं, वो न्यूट्रॉन्स हैं. (सोर्स - विकिपीडिया)
किसी एटम में कितने इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन हैं, इसी से उसकी पहचान तय होती है. और यही बात एक एटम को दूसरे से अलग बनाती है. अब तक हम जितने एटम तलाश पाए हैं, हमने उनकी एक टेबल तैयार कर ली है. और इस टेबल का नाम है पीरियॉडिक टेबल.
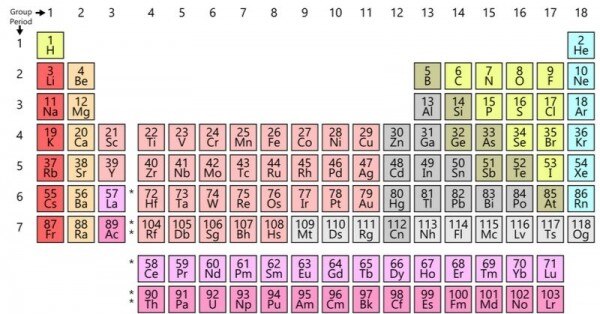
ये पीरियोडिक टेबल है. अब तक कुल 118 एटम्स खोजे जा चुके हैं. (सोर्स - विकिपीडिया)
पीरियॉडिक टेबल में तीसरे नंबर का एटम यानी लिथियम हमें 1817 में मिला. और इसी लिथियम से सबसे जबर बैटरी बनाई गई. लिथियम से बैटरी बनने की कहानी जानने से पहले हमें बैटरी के भीतर झांकना होगा.
बैटरी के भीतर क्या है?
हम बचपन से देखते आए हैं कि किसी भी बैटरी के दो टर्मिनल होते हैं प्लस (+) और माइनस (-). प्लस (+) साइड वाले को कैथोड कहते हैं, और माइनस (-) वाली साइड को एनोड. बैटरी के अंदर एनोड और कैथोड के बीच एक मिश्रण भरा होता है. इस मिश्रण को इलेक्ट्रोलाइट कहते हैं.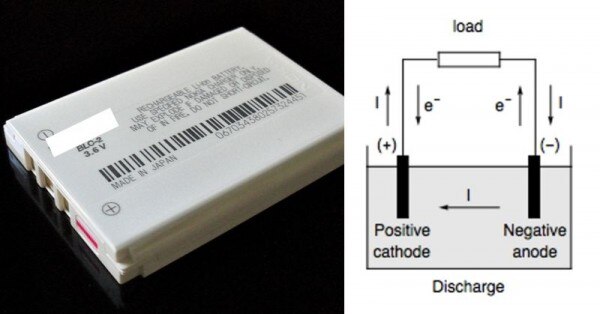
बैटरी और उसके अंदर का झोल. (सोर्स - विकिमीडिया)
बैटरी के अंदर कैथोड, एनोड और इलेक्ट्रोलाइट के बीच ऐसा झोल (केमिकल रिएक्शन) होता है कि इलेक्ट्रॉन्स एनोड की तरफ जमा हो जाते हैं. जब हम बैटरी से तार लगाकर करेंट से ले रहे होते हैं तो इलेक्ट्रॉन्स एनोड से निकलकर तार के रास्ते से कैथोड में जाते हैं.
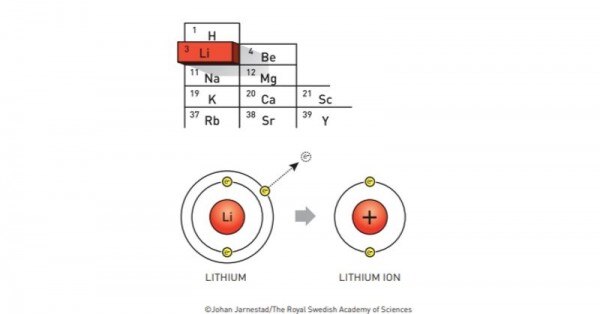
जो इलेक्ट्रॉन्स एनोड में इकट्ठे हुए हैं वो एनोड में मौजूद एटम्स से ही निकलते हैं. और जब किसी एटम से कोई इलेक्ट्रॉन निकल जाता है तो उसपर एक पॉज़िटिव चार्ज चढ़ जाता है. और इसी चार्ज चढ़े एटम को ही हम 'आयन' कहते हैं.
एक तरफ जहां एनोड पर इलेक्ट्रॉन्स इकट्ठे होते हैं. वहीं, आयन्स इलेक्ट्रोलाइट मिश्रण से होते हुए बैटरी के अंदर कैथोड की तरफ इकट्ठे हो जाते हैं. जब हम बैटरी से करेंट ले रहे होते हैं तो अंदर ये सब हो रहा होता है. इससे बैटरी डिस्चार्ज हो जाती है.
जब हम बैटरी को चार्ज करते हैं तो ये सारी प्रोसेस उल्टी हो जाती है. इलेक्ट्रॉन्स उल्टी तरफ बहते हैं और अपने आयन के साथ मिलकर वापस एटम बना लेते हैं.
लिथियम ऑयन बैटरी
70 के दशक में दुनिया में तेल का संकट आया. इस संकट ने हमें उर्जा के दूसरे इंतज़ाम करने के लिए मजबूर कर दिया. और 1976 में स्टेनली व्हिटिंगम ने लिथियम आयन बैटरी की नींव रखी. इससे पहले भी कुछ रीचार्जेबल बैटरीज़ सामने आ चुकी थीं, मगर लिथियम को दो बातें बहुत कमाल की थीं -1. लिथियम का इलेक्ट्रॉन बहुत ढीला होता है. मौका मिलते ही इसका इलेक्ट्रॉन एटम छोड़ कर भाग जाता है. और यही हमें बैटरी में चाहिए होता है. इलेक्ट्रॉन्स बहाने हैं. करेंट बनाना है.व्हिटिंगम की बैटरी के बारे में खास बात ये थी कि -
लिथियम के बाहर वाले ऑर्बिट का ढीला इलेक्ट्रॉन निकलता है और लिथियम आयन बन जाता है. (सोर्स - नोबेल)
2. लिथियम एक बहुत ही हल्का एटम होता है. बैटरी को इधर-उघर ले जाने के लिए उसका हल्का होना बहुत ज़रूरी है. इसलिए हमें बैटरी बनाने के लिए कम वज़न वाली चीज़ें ही चाहिए होती हैं.
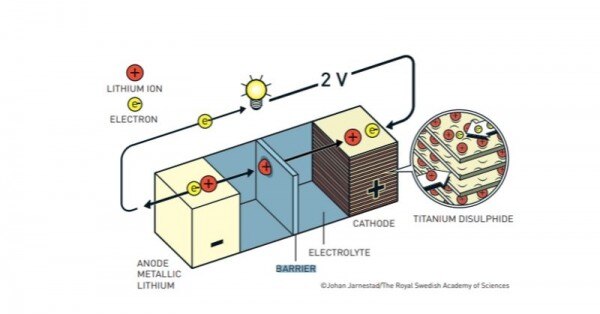
# इसका कैथोड टाइटेनियम डायसल्फाइड से बना हुआ था. टाइटेनियम डायसल्फाइड के बीचों बीच खाली जगह रहती है. और इसी खाली जगह में लिथियम के आयन्स रह सकते हैं.व्हिटिंगम की ये बैटरी थी तो बढ़िया लेकिन इसका वोल्टेज बहुत कम था. सिर्फ दो वोल्ट.
# इसका एनोड मुख्यरूप से लिथियम से बना हुआ था. डिस्चार्जिंग के दौरान लिथियम फटाक से इलेक्ट्रॉन छोड़ता है. ये इलेक्ट्रॉन तार से होते हुए कैथोड जाता है और करेंट पैदा होती है. बैटरी के अंदर ही अंदर इलेक्ट्रोलाइट मिश्रण से होते हुए लिथियम आयन कैथोड की तरफ जाता है. और वहां मौजूद खाली जगह पर अपना डेरा डाल लेता है.
व्हिटिंगम की बैटरी. (सोर्स - नोबेल)
1980 में जॉन गुडइनफ़ ने कैथोड से टाइटेनियम डायसल्फाइड हटाकर कोबाल्ट ऑक्साइड भर दिया. इससे बैटरी का वोल्टेज 2 वोल्ट से बढ़कर 4 वोल्ट हो गया. इस तरह गुडइनफ़ के जुगाड़ ने बैटरी की ताकत को डबल कर दिया.
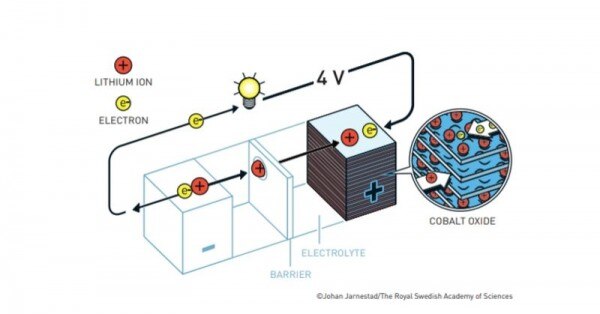
गुडइनफ की बैटरी. (सोर्स - नोबेल)
लिथियम आयन बैटरी पहले से ज़्यादा ताकतवर तो हो गई लेकिन इसे बेचने में एक दिक्कत थी. और ये दिक्कत थी बैटरी के एनोड में लगा लिथियम. लिथियम बहुत ही गुस्से वाला एलीमेंट होता है. हर दूसरी चीज़ से इसके फट पड़ने का डर रहता है. केमिस्ट्री में इसे रिएक्टिव होना कहते हैं. लिथियम बहुत ज्यादा रिएक्टिव होता है. और इसलिए सेफ्टी को ध्यान में रखते हुए, इस लिथियम आयन बैटरी को बेचना ठीक नहीं समझा गया.
1985 में अकीरा योशिनो ने पहली बेचने लायक बैटरी बनाई. इस बैटरी के एनोड में पेट्रोलियम कोक का इस्तेमाल किया गया. पेट्रोलियम कोक एक कार्बन का पदार्थ होता है, जिसके बीचों-बीच लिथियम आयन को रखा जा सकता है. और ये बैटरी सेफ भी है.
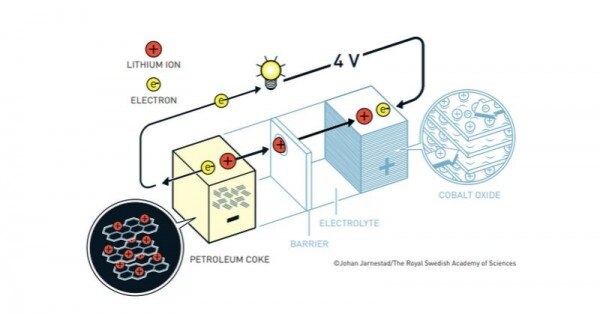
योशिनो की बैटरी. (सोर्स - नोबेल)
योशिनो की बनाई बैटरी ने 1991 में पहली बार बाज़ार का चेहरा देखा. और तब से लेकर अब तक ये हमारे चेहरे की रौनक बनाए हुए है.
वीडियो - दुनिया में सिर्फ दो लोगों के पास नोबेल और ऑस्कर दोनों हैं

.webp?width=120)